L’état actuel de plus de 1250 moyens médicaux basés sur l’IA, l’IA
L’essor de l’intelligence artificielle (IA) et de l’apprentissage automatique (ML) a transformé l’industrie en soins de santé. Et en raison de la récente marche de Chatgpt et des instruments similaires, divers algorithmes d’IA sont entrés dans la vie de la population générale. Ces technologies changeront sans aucun doute la façon de pratiquer le médicament. Étant donné que les soins de santé sont une industrie où les décisions peuvent littéralement être une question de vie et de mort, l’importance d’une réglementation efficace ne peut être surmontée. Maintenant, c’est un enfer de défi, même pour les professionnels les plus expérimentés.
L’IA et la ML représentent de nouveaux défis réglementaires. Contrairement aux dispositifs médicaux traditionnels, ces technologies sont capables d’évoluer et d’apprendre au fil du temps. Cela signifie qu’ils pourraient fonctionner différemment dans le monde réel que lors des tests de marché. Bien que cela puisse signifier des résultats de patients améliorés, il pourrait également introduire les nouveaux risques à administrer. Ce qui n’est pas une tâche facile avec l’algorithme en constante évolution.

Historiquement, la FDA a été un pionnier mondial dans la régulation de nouvelles technologies dans les soins de santé. Des médicaments aux dispositifs médicaux, la FDA établit traditionnellement des normes, il n’est pas étonnant que tous les yeux soient sur l’organe de réglementation américain.
La FDA met traditionnellement à jour sa base de données d’IA prise en charge une fois par an, toujours dans les mois d’automne, il est donc temps de regarder ce que nous pouvons apprendre des dernières statistiques disponibles.
Maintenant, la base de données FDA compte un total de 1250 appareils (à partir de 950 l’an dernier). Depuis juillet 2025, aucun dispositif qui utilise une IA générative n’a été autorisé ou alimenté par de grands modèles de langue.
De zéro à Heroo
Il y a quelques années, le paysage réglementaire des technologies de l’IA et de la ML était presque non existant. L’approbation des dispositifs médicaux n’indiquait pas expressément si la technologie était basée sur l’IA. Cela a rendu difficile pour les agents de santé, les patients et les autres parties de comprendre dans quelle mesure l’IA a été intégrée dans les solutions médicales. Les inventeurs et les développeurs sont également sérieusement défendus car ils ne voient aucun moyen clair d’approuver les nouvelles technologies sur le marché. Il est essentiel de distinguer ces technologies basées sur l’IA, car des considérations et des conséquences uniques pour les utilisateurs et les patients.
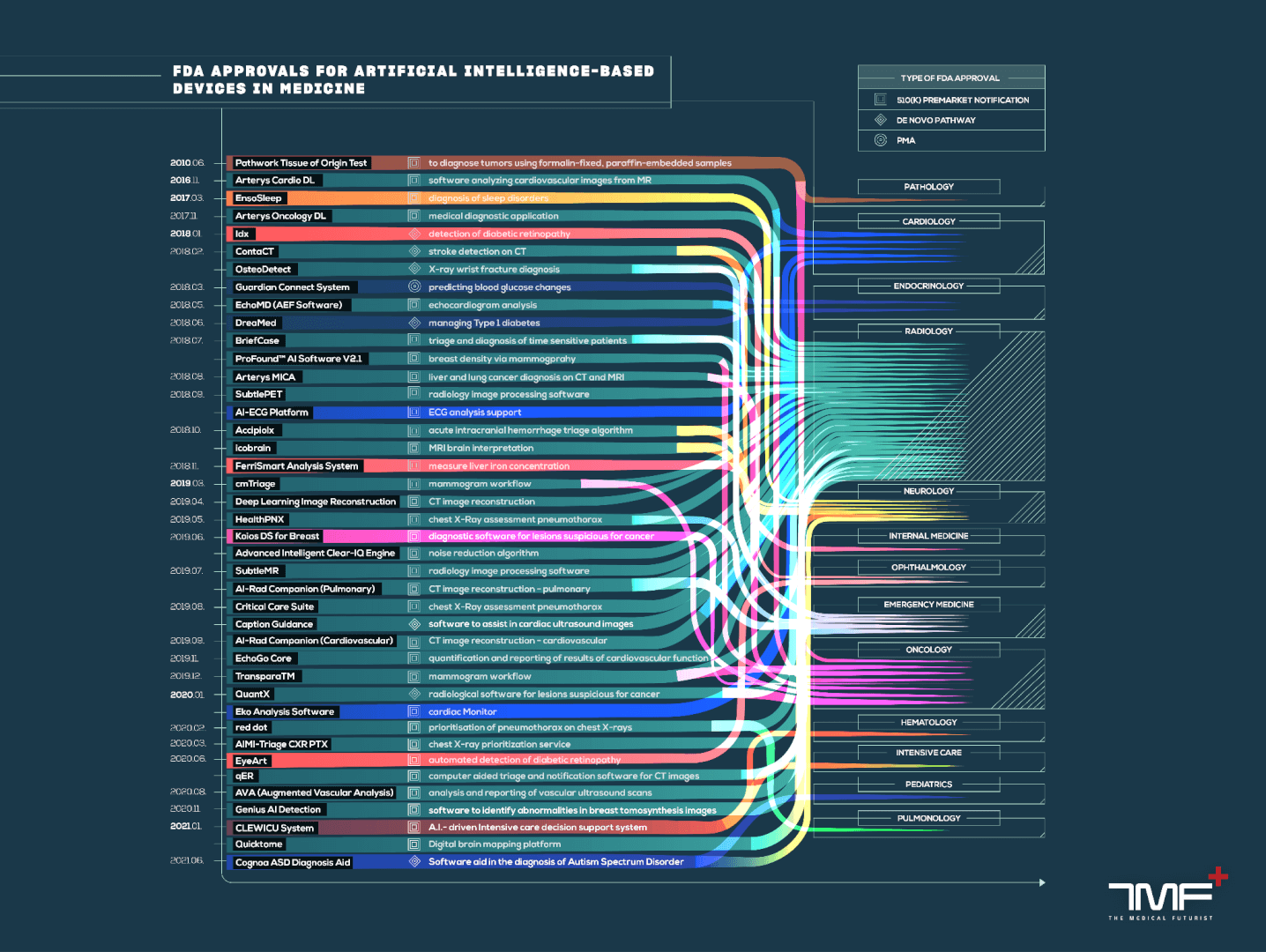
Pendant des années, la FDA a approuvé l’équipement basé sur l’IA, mais à l’origine ne les distinguait pas comme une catégorie unique. Il y a quelques années, nous nous sommes assistés à nous-mêmes au Medical Futuristic Institute pour rechercher toutes ces approbations et identifier celles basées sur l’IA. À partir de notre travail, nous avons créé une base de données en libre accès que nous avons partagée avec la FDA afin qu’ils puissent s’appuyer sur nos fondations. À notre satisfaction, un an plus tard, la FDA a publié sa propre base de données et nous a cités comme source.
Croissance exponentielle dont nous assistons maintenant
À ce jour, la dernière base de données indique un total de 1250 approbation. Voyez à quel point ce nombre se développe fortement:
- En 2017, la FDA a approuvé 27 appareils
- En 2018, 65 appareils
- En 2019 80 appareils
- En 2020, 114 appareils
- En 2021, 130 appareils
- En 2022, 162 appareils
- En 2023, 226 appareils
- En 2024, 235 appareils
- En 2025, 148 appareils.
Quelles spécialités sont les plus affectées?
Selon notre dernière analyse des données, la radiologie excelle comme l’IA de spécialité médicale la plus investie, qui possède des dispositifs incroyables 956 approuvés. Une seconde éloignée est la cardiologie ou le cardiovasculaire (comme catégorie) avec 116 appareils.
De plus, ils voient d’autres spécialités (neurologie, hématologie, urologie gastro-entérologique et ophtalmologie) pour voir une poignée d’installations. Quelle affichage motivé de ces hauteurs? Un enseignement profond a trouvé un terrain fertile en radiologie, qui est largement basé sur les données.
Voici une liste complète:
- Gastroentérologie / urologie 17
- Anesthésiologie 22
- Neurologie 56
- Hématologie 19
- Ophtalmique 10
- Chimie clinique 9
- Dentaire 6
- Chirurgie générale et plastique 6
- Microbiologie 6
- Pathologie 6
- Toxicologie clinique 5
- Orthopédique 5
- Hôpital général 4
- Obstétrique et gynécologie 3
Types de soumission de la FDA
La FDA reconnaît trois types de soumission différents: 510 (k), l’approbation avant le marché et la façon de novo. À long terme,
- 510 (k) est la plus populaire en 1195 (+271 depuis l’année dernière)
- Départ à nouveau 36 (+14)
- et marché préliminaire 16 (+12) loin derrière.
Pas étonnant que 510 (k) soit si populaire, tout simplement, c’est le moyen le plus simple, car c’est un chemin utilisé pour les appareils qui sont fondamentalement équivalents à un autre appareil légalement vendu. Aucune nouvelle évaluation clinique n’est requise, bien que les entreprises doivent prouver que leur équipement est aussi sûr et efficace que déjà approuvé.
Pendant ce temps, l’approbation avant le marché est le type de processus de demande de marketing le plus strict. Il est pour les dispositifs à haut risque et oblige le fabricant à fournir des preuves cliniques pour indiquer l’innocuité et l’efficacité de l’équipement. Cela comprend souvent une évaluation clinique, ce qui est cher.

Dro Novo Pathway est un itinéraire réglementaire pour les appareils à faible risque qui sont nouveaux et pour lesquels il n’y a pas de dispositifs de prédicat légalement vendus. Il convient aux dispositifs médicaux de classe I ou II (classification des risques plus faible).
Et voici la “liste supérieure de l’entreprise”, ce sont des entreprises avec les appareils pas consacrés à l’appui AM:
- GE Healthcare: 84
- Siemens Healthineers: 76
- Philips: 32
- Canon: 35
- Aidoc: 30
- Shanghai United Imaging Intelligence: 32
Nous continuerons à surveiller ce domaine, étant donné que l’approche de la FDA peut déterminer un précieux précédent pour les organismes de réglementation dans d’autres pays. Alors rejoignez-vous et restez à l’écoute – au cours des prochaines années, ils apprendront beaucoup.
Le poste de l’état actuel de plus de 1250 approuvé la FDA est apparu sur un futuriste médical pour la première fois sur l’IA.








